A primeira edição do Prêmio Nobel de Fisiologia ou Medicina foi concedida a Emil Behring em 1901 por seu trabalho pioneiro com terapia de soro. Hoje, sabemos que os componentes críticos dos soros são as imunoglobulinas, que visam patógenos, venenos e toxinas.
A resposta imune adaptativa é assim chamada porque se adapta em resposta a estímulos, o que chamamos de antígenos, adaptando o ambiente e as moléculas de reconhecimento. As células B expressam proteínas em forma de Y, conhecidas como receptores de células B, que quando secretadas, chamamos de anticorpos.
Os anticorpos são compostos por quatro cadeias: duas cadeias leves idênticas e duas cadeias pesadas idênticas. Cada cadeia tem domínios constantes e variáveis. A cadeia leve tem um domínio variável composto por genes V e J, enquanto a cadeia pesada tem genes V, D e J.
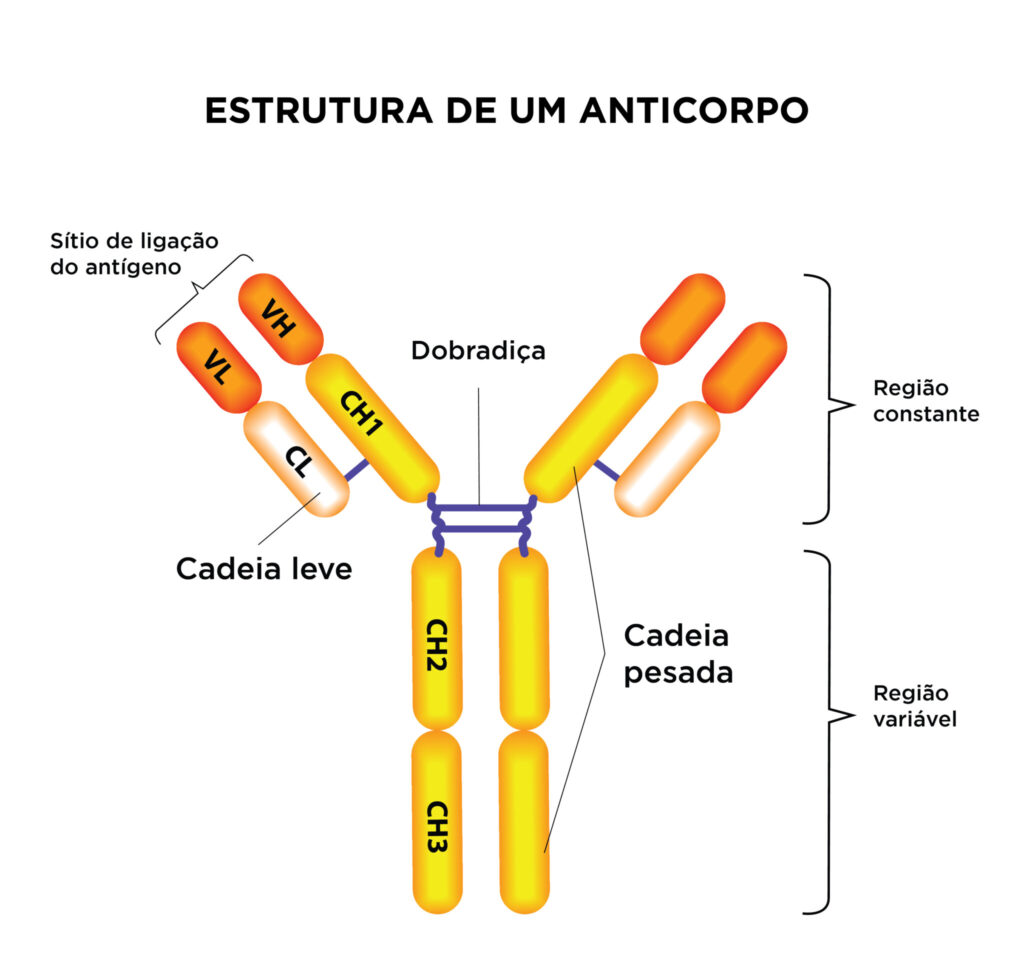
Você sabia que os anticorpos podem se ligar a quase qualquer proteína? Isso é possível graças à incrível diversidade de formas que os anticorpos podem ter. O sistema imunológico cria essa diversidade através de dois processos: recombinação VDJ e hipermutação somática.
Só com a combinação desses genes VDJ, podemos criar aproximadamente 1,21 x 1010 anticorpos únicos! E ainda tem todo o processo de hipermutação somática que envolve rodadas de mutações na região variável dos anticorpos.
Durante a diferenciação das células B, o genoma é editado para criar uma região de codificação principal que começa no gene V e se estende até o domínio constante. Esse mecanismo foi descoberto por Susumu Tonegawa, que ganhou o Prêmio Nobel em 1987.
A recombinação VDJ e a hipermutação somática permitem que o sistema imunológico crie uma diversidade incrível de anticorpos, tornando possível a ligação a quase qualquer proteína. Essa capacidade é fundamental para a defesa do nosso corpo contra doenças.